kernen i et atom er surround af elektroner, der optager skaller eller orbitaler af varierende energiniveauer.
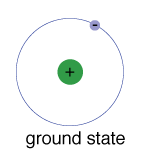
grundtilstanden af en elektron, er den energi det normallyoccupies, er den tilstand af laveste energi til at electron.
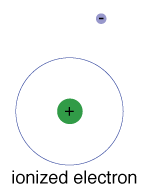
Der er også en maksimal energi, at hver elektron canhave og stadig være en del af sin atom., Ud over denne energi er elektronerne ikke længere bundet til atomets kerne, og det anses for at være ioniseret.
Når en elektron midlertidigt indtager en energitilstand større enddens jordtilstand er den i en ophidset tilstand. En elektron kanbliver ophidset, hvis den får ekstra energi, som om den absorberer en foton eller pakke af lys eller kolliderer med et nærliggende atom eller partikel.
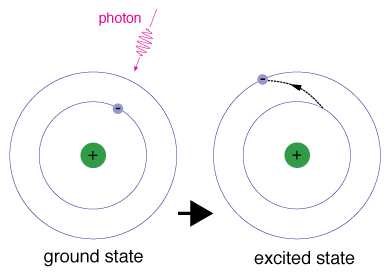
hver orbital har en specifik energi forbundet med den., For at anelectron skal øges til en orbital med en højere energi, skal denovervinde forskellen i energi mellem den orbital, den er i, og theorbital, som den går til. Det betyder, at det skal absorbere en foton, der indeholder netop den mængde energi, eller tage præcis den mængde energi fra en anden partikel i en kollision.
elektroner forbliver ikke i spændte tilstande i meget lang tid-de snartvende tilbage til deres jordtilstande og udsender en foton med samme energi somDen der blev absorberet.,

Overgange mellem de forskellige orbitals er unikke for hver elementbecause energi-niveauer er entydigt bestemt af protoner andneutrons i kernen. Når elektronerne i et bestemt atom vender tilbageat sænke orbitaler fra ophidsede tilstande har de fotoner, de udsender, energier, der er karakteristiske for den slags atom. Dette giver hverelement et unikt fingeraftryk, hvilket gør det muligt at identificereelementer til stede i en beholder med gas eller endda en stjerne.
Opdateret: November 2013.
Leave a Reply